Ideja da su sve tvari na svijetu sastavljene od atoma rođena je u 5. stoljeću prije Krista, kada je drevni grčki mislilac Demokrit sugerirao da sve što postoji sastoji se od najmanjih pokretnih čestica. Moglo se samo pretpostaviti da, najvjerojatnije, nije bez smisla. Mnoga stoljeća nakon Demokrita periodično su se prisjećali atoma, ali ta hipoteza nije bila popularna u onim dalekim vremenima. U 19. stoljeću atomska se hipoteza ponovno pojavila na znanstvenom horizontu.
Modeli strukture atoma

Znanstvenici su tražili model koji bi mogao zadovoljavajuće opisati sliku stvarnog svijeta. Atom se pokazao kao vrlo prikladan model. Iako se atomi ne mogu vidjeti, ali dopuštajući im da postoje, znanstvenici bi mogli objasniti što su opazili u svojim eksperimentima i u prirodi.
Znanstvenici su bili uvjereni u postojanje atoma mnogo prije nego što su mogli to dokazati. Model je djelovao, iako nitko nije mogao dokazati njegovu istinu. Na primjer, u ranom 19. stoljeću engleski znanstvenik John Dalton, proučavajući zakone kemijskih reakcija, otkrio je da dvije tvari uvijek kemijski reagiraju u istom konstantnom udjelu. Na primjer, kombinacija jednog dijela kisika i dva dijela vodika daje vodu.
To sugerira da se atomi jedne tvari, jednaki međusobno u masi, spajaju s atomima druge tvari (to jest, s atomima različite mase). U slučaju stvaranja vode, jedan atom kisika kombinira se s dva vodikova atoma.Atomski model pomogao je razumjeti što je točno Dalton promatrao u svojim eksperimentima. Daljnji su jednostavni dokazi za postojanje atoma.
Ako pogledate mikroskopom čestice peludi suspendirane u vodi, vidjet ćete da oni čine kaotične pokrete. Zašto? Znanstvenici su pretpostavili da se to može dogoditi zbog činjenice da se čestice peludi sudaraju s brojnim atomima ili skupinama atoma koje su znanstvenici nazvali molekulama (na primjer, čestice u vodi sudaraju se s molekulama vode).
Od čega se sastoji atom?
Znanstvenici koji su se složili s atomskom teorijom vjerovali su da se atom sastoji od malih električno nabijenih čestica - pozitivnih i negativnih, koje se, kada se kombiniraju u atomu, poput lopte, međusobno neutraliziraju i čine atom kao cjelinu električno neutralnom. No 1907. godine engleski fizičar Ernest Rutherford svojim je eksperimentima dokazao da to nije sasvim istina.
Rutherford iskustvo
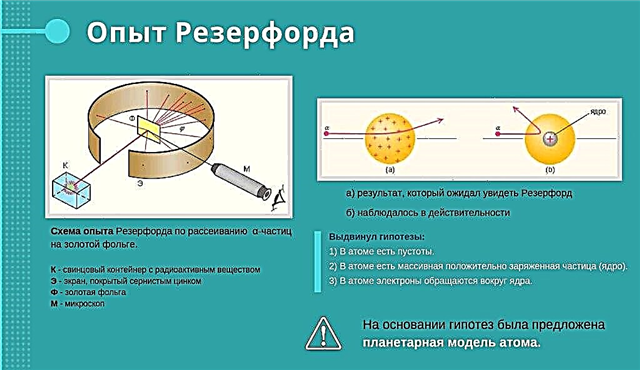
Rutherford je bombardirao zlatnu foliju s velikim brzinama pozitivno nabijenih čestica. Vjerovao je da će čestice proći kroz foliju. Neke pozitivno nabijene čestice letjele su kroz foliju. A neki to nisu mogli učiniti. Štoviše, ušli su u eksperiment, kao da ih je neka sila skrivena u foliji odgurnula. Rutherford je bio iznenađen. Rekao je da je to isto kao da počnete paliti lonac na vlaknastom papiru i odjednom vidjeti kako lonac leti s lončarskog čela.
Model planetarnog atoma - jezgra Atoma
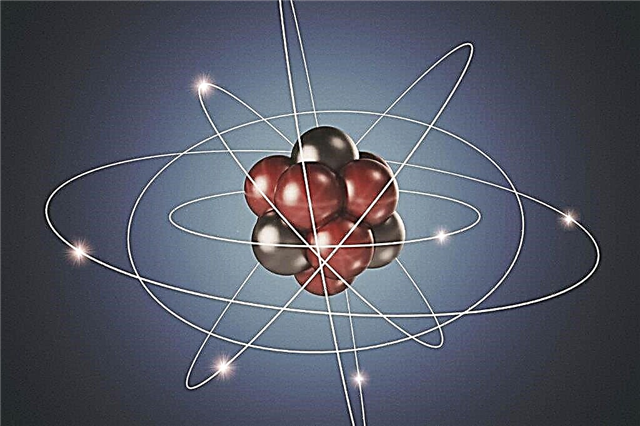
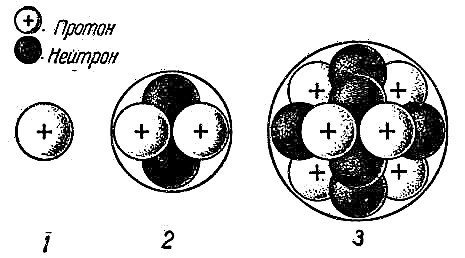
Rutherfordovi eksperimenti pomogli su potvrditi atomsku hipotezu i razumjeti kako atom radi. Postalo je jasno da pozitivne i negativne čestice nisu ravnomjerno raspoređene u atomu. Da je to tako, tada se pozitivno nabijene čestice u Rutherfordovom eksperimentu ne bi odbacile s takvom silom. Dakle, jezgra atoma nije neutralna. U sredini atoma nalazi se gusta kugla čestica, odnosno u sredini, koja se naziva jezgra atoma, nalaze se pozitivno nabijeni protoni i neutralni neutroni.
Na značajnoj udaljenosti od jezgre, negativno nabijene čestice - elektroni - vrte se oko njegove orbite oko sebe. Budući da je pozitivni naboj jednak po vrijednosti s negativnim nabojem, atom kao cjelina je električno neutralan. Ne nosi nikakav naboj.
Ali sama srž je koncentracija pozitivnog naboja. Mnoge pozitivne čestice u Rutherfordovom pokusu letele su preblizu pozitivno nabijenom jezgru zlatnog atoma. Budući da se pozitivni naboji međusobno odbijaju, te su čestice odletjele natrag prema eksperimentatoru. To mu je potaknulo ideju o tome kako su atomi zapravo raspoređeni.
Kvarkovi
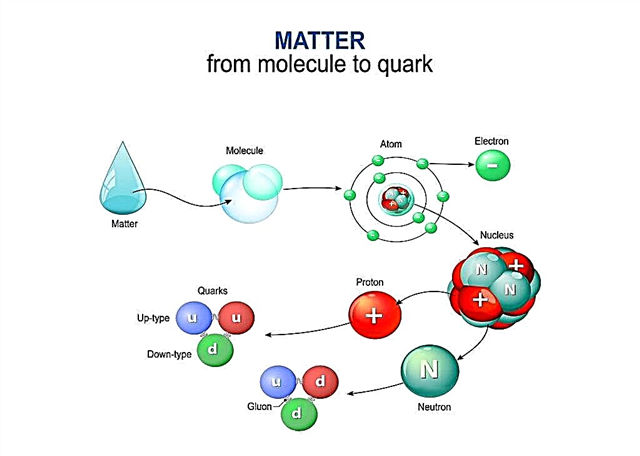
Protoni i neutroni su čestice koje se, iako su same male, sastoje od još manjih čestica koje nazivamo kvarkovima. Danas znanstvenici vjeruju da se protoni i neutroni sastoje od još manjih čestica koje nazivamo kvarkovima.
Kvarkovi su novi model koji bolje objašnjava ponašanje atoma u stvarnom svijetu. I baš kao što su znanstvenici i ranije tražili eksperimentalne dokaze za postojanje atoma, sada traže stvarnu potvrdu postojanja kvarkova.